作者:常雨轩 专利代理人
在审查指南(2017)中,对于补交实验数据部分进行了相应修改。具体而言,修改后的审查指南规定了:“判断说明书是否充分公开,以原说明书和权利要求书记载的内容为准。对于申请日之后补交的实验数据,审查员应当予以审查。补交实验数据所证明的技术效果应当是所属技术领域的技术人员能够从专利申请公开的内容中得到的。”虽然,审查指南对补充实验数据的规定进一步明确,但其中涉及的审查标准,笔者认为并没有做出实质改变。
在这里通过两个案例,笔者对于补交实验数据的审查标准进行了浅析。
案例1
专利号97180299.8 (299专利),无效决定号21646。
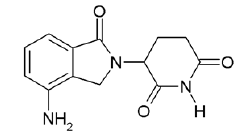
299专利的权利要求1所涉及的化合物:
无效请求人提交的证据6的化合物:
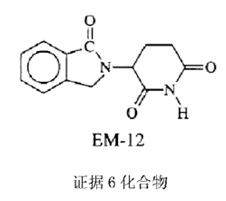
由以上结构可见,两种化合物的结构非常类似,那么在判断创造性时,是否具有预料不到的技术效果就尤为关键。
299专利在说明书中仅记载“(本发明的)化合物被用来抑制TNFα的不期望有的作用”以及“这些化合物还可以用于需要组织或抑制TNFα产生的人以外的哺乳动物的兽医治疗”,但是并未给出任何实验数据。
证据6记载了上述化合物(EM-12)可以控制TNFα的浓度异常。
为了证明299专利的创造性,专利权人递交了反证5来证明该专利化合物具有优于证据6的活性效果数据。
关于反证5所证明的效果是否是所属技术领域的技术人员能够从专利申请公开的内容中获得的,复审委给出以下意见:
“在阅读本专利说明书的内容后,本领域技术人员仅能够意识到本专利的化合物具有一般的TNFα抑制效果,而不会确信其具有超出常规水平的活性或其他预料不到的技术效果。
针对反证5,如果反证5仅证明了本专利的化合物取得了一般的TNFα抑制活性,则其无需补充实验数据,合议组在判断创造性时对此效果已经予以认可;如果反证5是用来证明本专利的化合物的技术效果优于本领域技术人员所认识到的现有技术的一般水平,例如明显优于证据6中公开的EM-12时,该信息是本领域技术人员在阅读原始申请文件后无法获知的内容,因此不允许补入。”
由此可见,当专利说明书中记载某种技术效果时,例如299专利中的TNFα抑制效果时,复审委认为,该方案只具有一般水平的技术效果,而并不能够从说明书中得出高于现有水平的预料不到的技术效果。
在专利申请中,为了能够证明权利要求具有预料不到的技术效果,通常还是需要将专利中已经公开的数据与最接近的现有技术进行对比。
在证明创造性时,是否提交的对比实验数据必须记载在专利说明书中呢?为此,笔者提出以下案例,供大家参考。
案例2:
专利号:200610002391.6(391专利),复审决定号:53337
391专利的权利要求1涉及
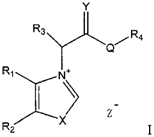
391专利的说明书中记载了:通式I化合物在体外和体内多种模型上有比USP5656261中披露的优选化合物ALT-711更好的AGE裂解活性和更低的毒性,并给出了裂解活性的数据,但是并没有毒性数据。
而审查员恰好采用了USP5656261和其中的ALT-711作为对比文件和最接近的现有技术。
申请人在实审阶段提交了以下数据来证明通式I化合物在毒性方面优于ALT-711。

对于这一数据,复审委的观点如下:
1.说明书记载了本申请的化合物比ALT-711毒性更低,表明其关注到了这一问题。
2. 对于毒性测定,采用常规方法就可以实现。
3. 采用的化合物是实施例的具体化合物,并且补充实验佐证了该技术问题得到解决。
因此,复审委接受了上述提交的补充数据。
由此可见,在上述情况下,复审委认可了上述实验数据证明的效果是能够从说明书中得到的技术效果。
综上,笔者认为,补交实验数据应满足以下要求:
数据必须与请求保护的范围相对应;
对比实验数据针对的技术效果应当是在原申请文件中有明确记载的;
对比实验数据应当在请求保护的发明与最接近的现有技术之间进行。
